科学家揭示了新的TEV介导的αPD-L1特异性治疗耐药机制
免疫检查点抑制剂,包括抗PD-1 和抗 PD-L1 抗体(αPD-1 和 αPD-L1),已经彻底改变了肿瘤免疫治疗。尽管 αPD-1 和 αPD-L1 在各种肿瘤类型中显示出优异的疗效,即使在晚期肿瘤患者中,由于原发性耐药,只有 10-30% 的患者对 αPD-1 和 αPD-L1 治疗有反应。
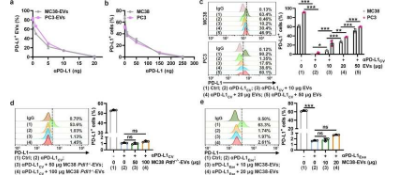
细胞外囊泡 (EV) 高度参与肿瘤的进展。PD-L1 +肿瘤衍生 EVs (TEVs) 引起全身免疫抑制,并可能抵抗 αPD-L1 阻断。然而,PD-L1 + TEVs 是否以及如何介导 αPD-L1 治疗耐药性仍然未知。
近日,浙江大学医学院蔡志坚教授课题组在Cellular & Molecular Immunology发表题为“Tumor extracellular vesicles mediate anti-PD-L1-therapy resistance by decoying anti-PD-L1”的文章。该研究结果揭示了一种新的 TEV 介导的 αPD-L1 特异性治疗耐药机制,从而为提高 αPD-L1 疗效提供了有希望的策略。
在这项研究中,研究人员发现TEVs可以在体外与αPD-L1结合并通过PD-L1与肿瘤细胞竞争。随后,作者将 αPD-L1 和肿瘤 PD-L1 相互作用可视化为通过邻近连接分析 (PLA) 检测到的红色荧光点。注射MC38-EVs而非MC38 Pdl1 -/- -EVs明显减少了肿瘤组织上的PLA斑点,而通过敲除Rab27a抑制内源性EVs的分泌,肿瘤组织中的PLA斑点显着增加。
此外,发现结合 TEV 后,αPD-L1 更多地被肝脏和脾脏中的吞噬细胞吸收,导致αPD-L1 加速降解和肿瘤递送减少。此外,他们发现 Pexidartinib (PLX3397) 对巨噬细胞的消耗显着减少了外周单核细胞和肝巨噬细胞的数量,消除了 TRAMP-C2 小鼠对 αPD-L1 治疗的抗性。
这些结果表明,靶向巨噬细胞有效地阻止了TEV结合的αPD-L1的清除,从而提高了αPD-L1的利用效率和治疗抵抗力。
“在肿瘤组织中,由于高压环境,能够渗入肿瘤组织深处的抗体较少。同时,这些抗体可以被大量的TEV快速捕获。因此,消耗αPD- TEVs介导的L1在临床治疗中需要得到更多关注,”蔡教授说。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
