新型硼载体有效硼中子俘获疗法治疗脑肿瘤
东京工业大学的研究人员证明,一种新型 硼剂可显着提高硼中子捕获疗法治疗胶质母细胞瘤的有效性。该药物被脑肿瘤细胞选择性吸收,具有增强的血液保留能力,并且可以低剂量给药。对细胞培养物、小鼠和大鼠的实验显示出有希望的结果,凸显了这种新型放射治疗剂的潜力。
胶质母细胞瘤 (GBM) 是一种高度侵袭性的脑肿瘤,起源于称为神经胶质细胞的大脑支持细胞。由于 GBM 生长迅速,手术切除 GBM 通常很困难,因此放疗成为最可行的选择。在众多现有的放射治疗方式中,硼中子俘获疗法(BNCT)对于GBM的治疗引起了广泛的关注。
BNCT 利用硼 10 ( 10 B) 原子对低能中子的高亲和力。当10 B 吸收中子时,核反应会释放高能粒子,损害附近的生物组织。因此,BNCT的一个基本要求是使肿瘤细胞中的10B浓度显着高于健康正常细胞中的浓度。然而,事实证明这具有挑战性,导致存活率低且 BNCT 的使用有限。
在此背景下,包括东京工业大学(Tokyo Tech)的 Hiroyuki Nakamura 教授在内的研究团队开发了一种新型硼剂,为 BNCT 显示了巨大的前景。这种分子——与 4-(对碘苯基)丁酸部分 (PBC-IP) 缀合的蝶酰基-十二硼酸盐——在他们最近发表在《控释杂志》上的研究中进行了彻底的测试。
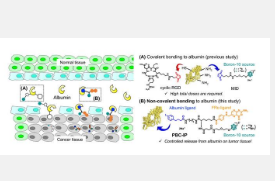
PBC-IP 由三个主要官能团组成(图 1):第一个是包含 12 个10 B 原子的硼基团,第二个是设计用于与叶酸受体 α (FRα) 结合的配体。这种受体在正常细胞中几乎不存在,但在包括 GBM 在内的各种癌症中大量过度表达。因此,它充当 PBC-IP 进入肿瘤细胞的入口点。最后,第三组是 4-( p-碘苯基)丁酸部分,将整个分子与白蛋白结合,白蛋白是血液中丰富的载体蛋白,可将物质输送到全身。PBC-IP 非共价结合天然存在的白蛋白,使其能够直接与肿瘤细胞相互作用,促进其细胞摄取。因此,酸部分可以增强硼剂的血液保留,从而潜在地减少所需的剂量。
研究人员进行了多项实验来证实 PBC-IP 对于 BNCT 的可行性,发现它在 GBM 细胞培养物中的积累量是日本临床批准的硼剂 L-4-硼苯丙氨酸 (BPA) 的 10-20 倍。此外,PBC-IP 本身没有显示出对细胞有性的迹象,证明了其安全性。“同样,向人类 GBM 异种移植模型静脉注射 PBC-IP 后,肿瘤中的硼积累量高于 BPA,从而有效抑制热中子照射后的肿瘤生长,”Nakamura 教授强调道。
这些有希望的结果也在 GBM 异种移植模型和大鼠神经胶质瘤模型中得到了体内复制(图 2)。通过对流增强递送 (CED) 在大鼠模型中施用 PBC-IP,在 CED 完成三小时后,肿瘤与正常脑和肿瘤与血液硼的比率分别为 37.8 和 94.6 。“BNCT 仅使用 PBC-IP 和 PBC-IP 联合 BPA 后 180 天的存活率分别为 50% 和 70%。没有残留脑肿瘤。”中村教授兴奋地说。
总体而言,所提出的硼剂可能代表 GBM 放射治疗的突破,研究人员目前正在进行临床前研究。
让我们希望他们的努力能够带来更好的工具来对抗 GBM 和其他癌症!
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
2025年6月20日,——在世界文化遗产地河南洛阳的光影流转之间,2025年新浪微博旅游之夜盛大举行。作为国内首个...浏览全文>>
-
2025年6月20日,——在世界文化遗产地河南洛阳的光影流转之间,2025年新浪微博旅游之夜盛大举行。作为国内首个...浏览全文>>
-
QQ多米试驾线下预约活动为了让更多用户感受QQ多米的独特魅力,我们特别推出了线下试驾预约活动。这不仅是一次...浏览全文>>
-
阜阳长安启源A07以其卓越的性能和豪华配置吸引了众多消费者的目光。作为一款定位高端市场的新能源车型,长安启...浏览全文>>
-
【安徽淮南大众CC新车报价2025款大公开】大众CC作为一款兼具运动感与豪华质感的轿跑车型,一直深受消费者喜爱...浏览全文>>
-
2025款长安猎手K50在安徽淮南地区的最新价格已新鲜出炉,为准备购车的朋友带来全面解析。这款车型以其高性价比...浏览全文>>
-
在安徽滁州购买长安猎手K50时,了解其落地价和省钱技巧至关重要。长安猎手K50是一款实用性强的皮卡车型,适合...浏览全文>>
-
途锐新能源是大众旗下的一款高端插电混动SUV,目前在安徽阜阳地区有售。其官方指导价约为58万元起,但实际成交...浏览全文>>
-
2025款大众CC作为一款兼具运动与豪华的中型轿车,备受关注。目前市场指导价大约在25万至35万元之间,具体价格...浏览全文>>
-
2024款探岳X作为一款备受关注的中型SUV,在市场上以其时尚的设计和出色的性能吸引了众多消费者。根据最新市场...浏览全文>>
- QQ多米试驾线下预约
- 安徽滁州长安猎手K50落地价,买车省钱秘籍
- 淮南大众CC新款价格2025款多少钱?买车攻略一网打尽
- 瑞虎8 PRO试驾,畅享豪华驾乘,体验卓越性能
- 安徽阜阳长安启源A05多少钱 2025款落地价,换代前的购车良机,不容错过
- 保时捷Macan试驾的流程是什么
- 安徽淮南大众ID.3多少钱?购车攻略在此
- 阜阳揽巡落地价,豪华配置超值价来袭
- 安徽池州威然 2024新款价格与配置的完美平衡
- 奇瑞瑞虎9试驾,新手必知的详细步骤
- QQ多米价格,换代前的购车良机,不容错过
- 池州迈腾GTE新款价格2022款多少钱?选车秘籍与优惠全公开
- 岚图追光多少钱 2024款落地价走势,近一个月最低售价25.28万起,性价比凸显
- 天津滨海威然 2024新款价格,最低售价28.98万起,入手正当时
- 蚌埠途昂新款价格2025款多少钱?购车必看
- 坦克400预约试驾全攻略
- 天津滨海ID.7 VIZZION价格,各配置车型售价全揭晓,性价比之王
- 安庆帕萨特最新价格2025款,最低售价12.35万起,入手正当时
- 亳州宝来新款价格2025款多少钱?选车指南与落地价全解析
- 生活家PHEV 2025新款价格,最低售价63.98万起现在该入手吗?
