利用肿瘤内微生物组对抗结直肠癌
肠道菌群被称为“被遗忘的器官”,其共生稳态对宿主健康发挥着重要作用。大量临床数据表明,多种肠道细菌可以通过粘膜系统进入血液循环,在各种类型的肿瘤组织中积聚和定植,形成“肿瘤内菌群”,并随着肿瘤进展而增殖。肠道和肿瘤内菌群通过调节致癌信号通路、促进诱变、改变化疗药物的代谢以及塑造宿主的免疫反应,对肿瘤的发生、进展和治疗反应产生重大影响。鉴于菌群与癌症之间错综复杂的联系,开发涉及肿瘤相关菌群调控的抗肿瘤疗法至关重要,特别是对于易受微生物侵袭的实体瘤,如结直肠癌。
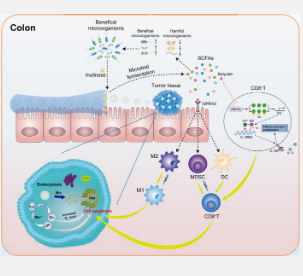
本研究开发了一种具有结肠靶向和结肠滞留作用的口服菊粉基水凝胶,其中含有负载化疗药物奥沙利铂(Oxa@HMI)的空心MnO 2纳米载体。菊粉凝胶基质通过增强生物粘附和延长结肠滞留时间,促进活性成分在病变部位的积聚和浓缩。这有助于结肠中有益细菌分泌的菊粉酶特异性降解Oxa@HMI中的菊粉,从而产生SCFAs。反过来,SCFAs通过调节有害和有益细菌之间的平衡来引发一系列抗肿瘤免疫反应。另一方面,菊粉凝胶基质的降解促进了内部纳米药物Oxa@HM的结直肠癌部位靶向暴露,Oxa@HM在酸性TME中降解生成Mn 2+ 和O 2,并释放负载的Oxa。产生的Mn 2+ 和O 2 通过产生ROS进一步加剧了TME中的氧化应激水平,从而显著抑制肿瘤生长(图1)。
我们首先对合成的Oxa@HMI纳米粒子进行了表征并验证了其体外性能。结果表明,Oxa@HMI纳米粒子在模拟胃肠液中能够保持良好的结构稳定性,从而能够以完整的纳米粒子形式递送至结直肠肿瘤部位。随后,表面的菊粉保护层会被TME中有益菌分泌的菊粉酶降解,从而充分暴露内部的纳米药物Oxa@HM发挥其抗肿瘤作用。与菊粉酶共孵育后,Oxa@HMI纳米粒子表现出优异的酸响应降解性能,并在溶液水平上表现出良好的生成ROS和O 2的能力 (图2A-H)。
随后,我们评估了Oxa@HMI纳米粒子在肿瘤细胞内的生物功能。结果表明,与菊粉酶共孵育后,Oxa@HMI纳米粒子能够在肿瘤细胞中有效产生O 2 和ROS,从而增强Oxa的治疗效果。此外,Oxa@HMI纳米粒子(与菊粉酶共孵育)对肿瘤细胞表现出显著的靶向细胞性,并显著促进肿瘤细胞凋亡(图2I-L)。
然后,为了方便口服和胃肠道给药,我们通过调节Oxa@HMI纳米粒上菊粉的修饰比例,构建了Oxa@HMI水凝胶,使其与肠黏膜层更好地黏附,延长肠道滞留时间(图3A-C)。我们进一步评估了Oxa@HMI水凝胶在原位结直肠癌小鼠体内的生物分布。结果表明,与其他组相比,Oxa@HMI水凝胶由于其黏附性能,可以黏附在肠黏膜上,从而延长纳米药物在结肠中的滞留时间,导致纳米药物在结肠肿瘤内的蓄积和浓度增加(图3D-H)。
随后,我们在原位移植结直肠癌小鼠和皮下移植结直肠癌小鼠体内验证了Oxa@HMI水凝胶的抗肿瘤效果。结果表明,具有结肠靶向性和结肠滞留性的Oxa@HMI水凝胶通过干预肿瘤组织内的微生物环境、提高化疗效率和激活抗肿瘤免疫反应,在两种小鼠模型中均表现出良好的抗肿瘤效果(图4)。
接下来我们通过高通量16S rRNA基因测序分别评估了原位结直肠癌小鼠肠道和肿瘤组织中菌群的变化。结果显示,在原位结直肠癌小鼠肠道和肿瘤组织中,口服Oxa@HMI水凝胶显著增加了产生SCFAs的有益菌的相对丰度,同时显著降低了促进肿瘤进展的有害菌的相对丰度(图5)。
最后我们利用流式细胞术分析了原位结直肠癌小鼠肿瘤内免疫细胞浸润水平。结果显示,Oxa@HMI水凝胶的微生物代谢产物SCFAs通过与肠道中的GPR43结合,激活CD8+T细胞中的HDACs/ID2/IL-12受体通路,引发一系列抗肿瘤免疫反应:显著提高肿瘤组织中CD8 +、IFN-γ + CD8 + 和CD4 + T细胞 的浸润水平 ,有效诱导DC的成熟,显著促进肿瘤相关M2巨噬细胞极化为促炎性M1巨噬细胞,并显著降低免疫抑制性MDSC的频率(图6)。
本研究首次建立了一种针对微生物的药物递送系统Oxa@HMI水凝胶,该系统表现出高效的结直肠癌靶向性和结肠滞留性。Oxa@HMI水凝胶通过干预肿瘤组织内的微生物环境,提高化疗效率,激活抗肿瘤免疫反应,在原位结直肠癌小鼠和皮下结直肠癌小鼠中均表现出良好的抗肿瘤效果,且表现出良好的生物安全性,对易受微生物侵袭的结直肠癌的临床转化和治疗具有巨大的潜力。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
2025年6月20日,——在世界文化遗产地河南洛阳的光影流转之间,2025年新浪微博旅游之夜盛大举行。作为国内首个...浏览全文>>
-
2025年6月20日,——在世界文化遗产地河南洛阳的光影流转之间,2025年新浪微博旅游之夜盛大举行。作为国内首个...浏览全文>>
-
QQ多米试驾线下预约活动为了让更多用户感受QQ多米的独特魅力,我们特别推出了线下试驾预约活动。这不仅是一次...浏览全文>>
-
阜阳长安启源A07以其卓越的性能和豪华配置吸引了众多消费者的目光。作为一款定位高端市场的新能源车型,长安启...浏览全文>>
-
【安徽淮南大众CC新车报价2025款大公开】大众CC作为一款兼具运动感与豪华质感的轿跑车型,一直深受消费者喜爱...浏览全文>>
-
2025款长安猎手K50在安徽淮南地区的最新价格已新鲜出炉,为准备购车的朋友带来全面解析。这款车型以其高性价比...浏览全文>>
-
在安徽滁州购买长安猎手K50时,了解其落地价和省钱技巧至关重要。长安猎手K50是一款实用性强的皮卡车型,适合...浏览全文>>
-
途锐新能源是大众旗下的一款高端插电混动SUV,目前在安徽阜阳地区有售。其官方指导价约为58万元起,但实际成交...浏览全文>>
-
2025款大众CC作为一款兼具运动与豪华的中型轿车,备受关注。目前市场指导价大约在25万至35万元之间,具体价格...浏览全文>>
-
2024款探岳X作为一款备受关注的中型SUV,在市场上以其时尚的设计和出色的性能吸引了众多消费者。根据最新市场...浏览全文>>
- QQ多米试驾线下预约
- 安徽滁州长安猎手K50落地价,买车省钱秘籍
- 淮南大众CC新款价格2025款多少钱?买车攻略一网打尽
- 瑞虎8 PRO试驾,畅享豪华驾乘,体验卓越性能
- 安徽阜阳长安启源A05多少钱 2025款落地价,换代前的购车良机,不容错过
- 保时捷Macan试驾的流程是什么
- 安徽淮南大众ID.3多少钱?购车攻略在此
- 阜阳揽巡落地价,豪华配置超值价来袭
- 安徽池州威然 2024新款价格与配置的完美平衡
- 奇瑞瑞虎9试驾,新手必知的详细步骤
- QQ多米价格,换代前的购车良机,不容错过
- 池州迈腾GTE新款价格2022款多少钱?选车秘籍与优惠全公开
- 岚图追光多少钱 2024款落地价走势,近一个月最低售价25.28万起,性价比凸显
- 天津滨海威然 2024新款价格,最低售价28.98万起,入手正当时
- 蚌埠途昂新款价格2025款多少钱?购车必看
- 坦克400预约试驾全攻略
- 天津滨海ID.7 VIZZION价格,各配置车型售价全揭晓,性价比之王
- 安庆帕萨特最新价格2025款,最低售价12.35万起,入手正当时
- 亳州宝来新款价格2025款多少钱?选车指南与落地价全解析
- 生活家PHEV 2025新款价格,最低售价63.98万起现在该入手吗?
