用于动态和引导抗菌的化学发光碳纳米点
光动力疗法(PDT)利用光激发光敏剂产生的活性氧(ROS)来实现疾病的诊断和治疗,已成为治疗各种细菌相关感染的临床策略。然而,PDT对外部光源的需求严重限制了其在深部组织病变诊断和治疗中的实际应用。《光科学与应用》杂志报道的化学发光碳纳米点(CD)动态引导抗菌疗法解决了这个问题。
CL作为一种由化学反应引发的发光,作为一种自发光光源,可在关节炎、腹膜炎、肿瘤等多种炎症相关疾病中实现PDT,引起了人们的广泛关注。因此,研究团队郑州大学物理与微电子学院河南省金刚石光电材料与器件重点实验室、材料物理教育部重点实验室单崇新教授带领团队制备了化学发光CD,并进一步设计了CL-动态/引导抗菌(CDGA)。自发光CDGA在早期检测细菌毒素引起的伤口感染和内部炎症方面表现出优异的体内成像质量,抑菌率为96.94% ~ 99。
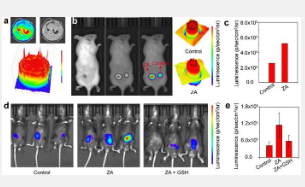
凭借持久余辉和近红外 (NIR) 发射深度穿透的优点,CDGA 可用作炎症相关 ROS 体内 CL 图像的可激活显像剂。如图 1a 所示,CDGA 和 H 2 O 2的混合水溶液说明了实验室培养皿中不同的 CL 发射强度,使 CDGA 能够描述 H 2 O 2的分布。而通过 NIR CL 发射和 CL 分布的 CL 图,体内 CL 成像可用于研究不同炎症部位的 ROS 水平和分布。在此,利用细菌外毒素Zymosan A (ZA)建立细菌炎症模型的两个后部,以诱导炎症并进一步产生过量的H 2 O 2。如图1b所示,通过直接用ZA处理小鼠伤口来模拟伤口细菌感染,建立表皮伤口模型。在模型中,喷洒CDGA水溶液后,有伤口的皮肤比普通皮肤能发出更强烈的CL发射(图1c),证实了ZA诱导的炎症的存在。同时,伤口中的CL发射分布可以针对可能的细菌感染呈现不同严重程度的症状。此外,CDGA在深部炎症的体内CL生物成像中也表现出优异的性能。通过腹腔注射ZA模拟腹内细菌感染建立炎症小鼠模型。24小时后,随后在注射 CDGA 后捕获小鼠模型的深层穿透性炎症生物图像。如图 1d 所示,与对照组相比,用 ZA 处理的小鼠腹内部位表现出更高的 CL 信号。ZA 处理的具有深层腹部组织的小鼠的 CL 诊断信号几乎比对照小鼠高 2.5 倍。此外,用抗氧化剂谷胱甘肽(GSH)治疗腹部深部组织感染的小鼠后,ZA/GSH治疗小鼠的CL信号显示出40%的减少(图1e)。作为炎症到正常的对比信号,增强到降低的 CL 强度可以有效监测活体动物细菌感染的变化。这些研究表明 CDGA 可用作活体炎症反应显像剂,
正如之前的报告, 1 O 2、•OH 和•O 2的产生- 来自光化学反应可对细菌膜造成有效的氧化损伤。在细菌感染部位,高表达H2O2的炎症微环境可以触发CDGA的CL发射,并进一步实现自发光PDT,这意味着它们作为抗菌纳米药物的潜在应用。在这项工作中,首先研究了在黑暗条件下用 CDGA 处理的大肠杆菌的扁平计数图像。如图 2a 所示,CDGA 对大肠杆菌的抑菌率为 98.76%。在此条件下,直观地进一步研究了 CDGA 的抗菌活性。如图2b和2c所示,通过LIVE/DEAD染色和扫描电子显微镜(SEM)观察CDGA处理前后大肠杆菌的活力和形态。在SYTO 9和PI染色细菌的共焦激光扫描显微镜(CLSM)图像中,未经CDGA处理的对照组表现出绿色荧光,与正常活细菌相对应。然而,用CDGA处理的实验组显示出明亮的红色荧光,表明CDGA诱导细菌死亡。同时,SEM图像表现出明显的形态变化。在这些大肠杆菌中,对照组表现出球形和杆状,具有有光泽且未受损的膜,而与CDGA一起孵育的细菌表现出部分起皱和细菌膜破裂。膜的改变表明基于 ROS 的 PDT 引起细菌膜的损伤,这与 CDGA 的预期抗菌机制一致。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
