人类诱导多能干细胞衍生的心肌细胞片的免疫原性
缺血性心脏病是全球发病率和亡率的重要原因。一种有希望的治疗方法是使用人类诱导多能干细胞衍生的心肌细胞 (hiPS-CM)。hiPS 细胞源自成人体细胞(例如血液或皮肤细胞),能够分化成各种组织,包括心肌细胞。这些细胞可能可以修复受损的心脏组织,但由于担心免疫排斥,其临床应用受到限制。了解 hiPS-CM 的免疫原性对于推进其治疗用途至关重要。
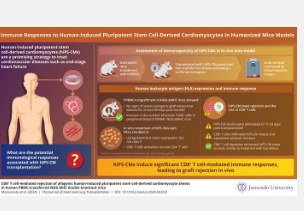
为了解决这一空白,由日本东京顺天堂大学医学院免疫治疗与诊断中心的博士生 Ryu Matsumoto 领导的研究小组,以及日本鹿儿岛大学医学和牙科研究生院消化外科、乳腺和甲状腺外科的临床外科医生,开创了一种新型人源化小鼠模型,旨在探索对 hiPS-CM 的免疫反应。该研究由日本东京顺天堂大学医学院免疫治疗与诊断中心的助理教授 Yin Enzhi 共同领导,副教授 Koichiro Uchida 也参与其中。他们的研究结果于 2024 年 4 月 22 日在《心肺移植杂志》上在线发表。
松本在解释本研究的动机时说:“作为一名外科医生,我非常清楚晚期心血管疾病患者心脏捐赠的严重短缺。尽管移植 hiPS-CM 薄片可能是一种新的治疗选择,但这些薄片的免疫排斥问题对其临床安全性和疗效构成了重大障碍。因此,人源化小鼠模型可以成为预测和理解这种免疫排斥的宝贵工具,为更安全、更有效的 hiPS-CM 薄片移植程序铺平道路。”该团队首先通过严格的基因改造和精确的实验程序对 hPBMC-NOG-ΔMHC 小鼠进行工程改造。
NOG-ΔMHC 小鼠是通过将 NOG 小鼠的免疫缺陷特征与一项关键改变相结合而创建的:消除主要组织相容性复合体 (MHC) I 类和 II 类表达。这种基因改造在降低移植人体细胞的免疫排斥可能性方面起着关键作用,从而能够更有效地研究细胞疗法。现在,研究人员通过向这些免疫缺陷小鼠体内引入人类外周血单核细胞 (hPBMC) 来“人性化”这些小鼠。这种创新方法增强了该模型在研究人类免疫反应和评估涉及人类细胞移植的治疗策略方面的相关性。
体外实验表明,hiPS-CM 仅表达人类白细胞抗原 (HLA) I 类分子并诱导有限的免疫反应。然而,在 hPBMC-NOG-ΔMHC 小鼠模型中,hiPS-CM 薄片在移植后约 17 至 24 天被排斥。这种排斥主要由 CD8 + T 细胞引起,这是一种负责直接攻击外来或受感染细胞的免疫细胞。这些 CD8 + T 细胞渗入移植部位,并被发现产生更高水平的 IFN-γ(干扰素-γ),这是一种由免疫系统产生的分子,有助于激活免疫反应。
重要的是,在没有将 hPBMC 转移到小鼠体内的情况下,这种免疫介导排斥并不明显,这强调了这些免疫细胞在产生抗移植反应方面的关键作用。该研究进一步表明,CD8 + T 细胞的消耗或使用免疫抑制药物他克莫司治疗可显著延长 hPBMC-NOG-ΔMHC 小鼠体内 hiPS-CM 片的存活时间,这强调了 CD8 + T 细胞在排斥过程中的关键作用。
在深入研究其研究成果的实际应用时,松本表示:“我们的研究为开发最佳免疫抑制策略铺平了道路,有可能在不久的将来使 hiPS-CM 片移植成为许多严重心力衰竭患者的现实。”
这项研究揭示了 CD8 + T 细胞的作用及其相关机制,这些机制导致人类 iPS 衍生细胞产品的排斥。通过以患者为中心的方法并充分考虑免疫抑制策略,hiPS-CM 薄片移植可能被证明是终末期心力衰竭患者挽救生命的干预措施。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
