科学家发现了一组致命的小儿神经退行性疾病的生物标志物和疗法
得克萨斯儿童医院和贝勒医学院的一项激动人心的研究确定了分子生物标志物和两种治疗婴儿神经轴索营养不良 (INAD) 的有效方法,INAD 是一种破坏性和致命性的儿科神经退行性疾病。
在eLife发表的一篇论文中,贝勒医学院杰出服务教授 Hugo J. Bellen 博士及其在德克萨斯儿童医院 Jan 和 Dan Duncan 神经病学研究所 (Duncan NRI) 的研究团队使用各种 INAD 疾病模型来发现这种疾病的关键分子特征,这将有助于研究人员和临床医生为 INAD 患者设计有针对性和有效的治疗方法。
该研究进一步扩展了这些发现,以确定四种已知药物和一种新的临床前靶向基因治疗方法,该方法成功地逆转了 INAD 动物模型中的一些潜在分子缺陷、减轻了疾病症状并延长了寿命。
这项工作在 INAD/PLA2G6 相关神经退行性疾病方面取得了令人难以置信的进步,并为这些目前无法治愈的疾病开辟了可行且有效的治疗选择。
脂质循环中断是 INAD 症状的基础
INAD 是一种罕见的神经系统疾病,会导致受影响儿童的运动和认知能力迅速衰退。它的特点是肌肉张力丧失、癫痫发作、某些大脑区域的解体和视力障碍。通常,患有 INAD 的儿童活不过他们生命的第一个十年。
它是由 PLA2G6 基因的变异引起的,该基因编码一种称为 A2 磷脂酶的酶。PLA2G6 的变异导致 INAD 和其他两种迟发性帕金森样疾病,非典型 NAD (aNAD) 和帕金森病 14 (PARK14),它们统称为 PLA2G6 相关神经变性 (PLAN)。
Guang Lin 博士和 Bellen 实验室的其他人在 2018 年进行的一项研究报告称,缺乏 PLA2G6 基因的果蝇表现出缓慢进行性神经退行性变的迹象,例如寿命缩短、运动和视力缺陷,并呈现出与神经元中所见相似的细胞特征INAD 患者。此外,他们发现细胞脂质的异常循环和运输是 INAD 疾病症状的主要原因。
为了以最少的能量消耗维持膜中脂质的最佳平衡,细胞使用细胞内回收途径重复使用和回收膜脂质,例如神经酰胺磷酸乙醇胺 (CPE) 和鞘磷脂 (SM)。逆转录酶蛋白是回收途径的重要组成部分,该途径在到达溶酶体之前从内吞膜中提取各种细胞成分,并将它们带回质膜。
未回收的 CPE 和 SM 被运送到溶酶体,在那里它们被分解成神经酰胺,然后在膜中重新使用。Bellen 团队发现,INAD 果蝇中 PLA2G6 蛋白的缺失会破坏逆转录复合物的稳定性并破坏其回收能力,从而导致神经酰胺积累。
林博士等人提出的第一个问题。本文测试的是 INAD 细胞缺陷是否在不同物种中进化保守。
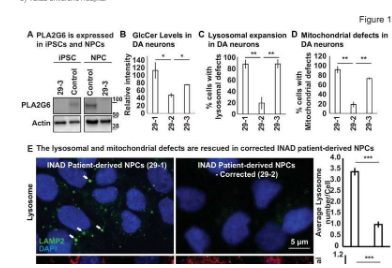
他们发现,从患者细胞衍生的多巴胺能神经元神经祖细胞和从与 INAD 相关的大脑区域获得的 PLA2G6 突变小鼠神经元表现出相似的细胞缺陷——神经酰胺的积累、溶酶体的扩大以及线粒体结构和功能的缺陷,细胞的能量发电厂——表明它们在 INAD/PARK14 的发病机制中的关键作用。
四种已知药物可逆转 INAD 果蝇和患者来源的神经元细胞的疾病症状
他们的下一个目标是确定 INAD 的治疗策略。他们首先回顾了医学文献,以寻找据报道可调节鞘脂代谢、细胞内蛋白质运输和治疗帕金森病的药物。使用这些标准,他们发现了 20 种潜在的候选药物,这些候选药物的功效在 INAD 果蝇中进行了测试,使用的是作为癫痫发作读数的爆炸敏感性测定。
“其中,四种已知药物在这些果蝇中表现出对癫痫发作易感性的剂量依赖性改善,并且在 INAD 患者来源的神经祖细胞中没有表现出任何毒性迹象,”贝伦研究所助理教授林博士说。实验室。
“此外,这些药物还显示出显着逆转 PLA2G6 诱导的细胞缺陷和降低的神经酰胺水平以及溶酶体的大小,表明细胞内交通流的流动得到恢复”。令人鼓舞的是,其中三种药物用于治疗其他疾病。
临床前基因治疗抑制 INAD 患者来源细胞和小鼠模型的运动缺陷
他们的下一个目标是测试基因治疗方法是否能有效治疗 INAD 患者。
Bellen 团队此前发现,在 INAD 果蝇模型中,人类版本的 PLA2G6 基因的全身表达可以恢复神经退行性变的症状并恢复正常寿命。然而,这种转基因仅在神经元中的特异性表达挽救了神经退行性表型,但并未延长寿命。这表明虽然该基因在神经系统中显然起着关键作用,但它在其他细胞中也是必需的。
基于这一观察,他们设计了一种基于腺相关病毒 (AAV) 的基因治疗方法,可以将人类 PLA2G6 基因传递给尽可能多的细胞类型。有趣的是,这些病毒载体在 INAD 患者来源的神经祖细胞中的表达诱导了人 PLA2G6 的低水平表达,这足以部分缓解两个关键症状:溶酶体扩增和线粒体结构缺陷。
受到这些有希望的结果的鼓舞,该团队将人类 PLA2G6 注射到脑脊液(脑室)和血液中,发现这种转基因的表达不仅对小鼠安全,而且还成功地延迟了运动的发作缺陷并延长成年症状前 INAD 小鼠的寿命。
“我们希望这项研究不仅能促进我们对 INAD/PLA2G6 相关疾病的潜在机制的理解,而且这些有价值的见解将引起人们对这组致命疾病的更多兴趣并加速治疗的发展,这是对 INAD/PLA2G6 相关疾病的迫切需要影响了儿童和他们的家人,”贝伦博士说。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
