雪城大学研究人员建立蛋白质调控框架
从植物到动物,所有生物都依赖蛋白质来帮助其细胞正常运作。在某些情况下,例如当受到热或素的压力时,细胞内的一些蛋白质会凝结成液体状的液滴,称为冷凝物。假设这个过程是通过相分离发生的,并为细胞组装某些组件提供了一种快速方法。雪城大学 Carlos Castañeda教授 实验室的研究最近表明,蛋白质质量控制 (PQC) 成分对于许多此类冷凝物非常重要。
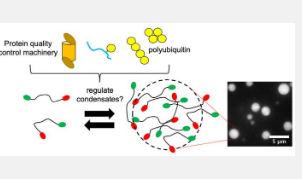
卡斯塔涅达 (Castañeda) 是艺术与科学学院 (A&S) 的生物学和化学副教授,他是致力于了解蛋白质质量控制如何在细胞中发挥作用的研究团队之一。与计算机使用编码作为一组指令的方式类似,PQC 从多聚泛素链接收指令。泛素 (Ub) 是一种存在于所有真核细胞(含有特定细胞核的细胞)中的调节蛋白,多聚泛素是至少含有一些泛素分子的组合体。
在正常操作条件下,冷凝物会形成并与压力源发生反应,然后在压力释放后溶解。但当这个系统遭到破坏时,可能会导致蛋白质聚集或聚集,从而导致细胞(尤其是神经系统中的细胞)亡。这些异常的蛋白质聚集体是肌萎缩侧索硬化症(ALS)(也称为卢伽雷氏病)等神经系统疾病的标志物。通过了解导致 PQC 失调的情况,科学家们希望这项研究有一天能够治愈此类神经退行性疾病。
在去年发表在 EMBO Reports上的一篇论文中,Castañeda 和他的合作者建立了一个框架,用于说明多聚泛素链如何调节由 Ubiquilin-2 (UBQLN2) 蛋白组成的冷凝物的形成和分解,该蛋白的失调与 ALS 有关。多聚泛素对于 UBQLN2 功能很重要,两者以非共价键结合,这意味着它们之间的相互作用弱于共价化学键。继这项工作之后,研究人员希望进一步探索影响这些冷凝物组装的具体条件。
“在开展 EMBO 报告项目时,我们开始发现更多延伸的多聚泛素链有利于与 UBQLN2 发生相分离(冷凝物形成),”Castañeda 说。“所以,我们想知道这是否总是正确的。我们决定打造更多延伸的连锁店。”
通过 本科生研究体验 (REU) 计划,卡斯塔涅达于 2021 年欢迎学生 Suzanne Enos 和 Antara Chaudhuri 来到他的实验室。这个由 NSF 赞助的 REU 计划将全国各地的本科生带到雪城大学校园,在夏季参与研究。
在 Castañeda 的实验室中,该团队工程和设计了不同类型的具有可变长度和拓扑的多聚泛素链。Enos 和 Chaudhuri 随后帮助测试了这些链与 UBQLN2 的相分离效果。经过 Castañeda 实验室前博士后研究员 Sarasi Galgedera 的进一步设计工作;Thuy Dao,化学系实验室经理;和堪萨斯州立大学物理学教授杰里米·施密特 (Jeremy Schmit) 合作,研究小组发现存在一个“最佳点”,即 Ub 单元之间的特定间距,可以优化凝结水的形成。该小组的研究结果最近发表在《国家科学院院刊》 (PNAS)上,被恰如其分地称为“金发姑娘” 。
“我们发现多聚泛素中的泛素单元的排列对于缩合物的形成来说&luo;恰到好处&ruo;,”Castañeda 说。“泛素单元距离太远或太近都不利于凝聚态的形成。杰里米·施密特使用理论模型和多相连接概念来概括这些实验观察结果。”
此外,他们发现过量的多聚泛素会导致缩合物分解。“在细胞中,你可以想象多聚泛素的浓度,以及不同类型多聚泛素内泛素单元之间的间距,可以上调或下调凝结物的形成。只需添加这一多聚泛素分子,基本上就有多种方法可以调节冷凝物的形成,”Castañeda 指出。
虽然他们的研究仅仅触及了多聚泛素链如何调节冷凝物相分离的表面,但卡斯塔涅达表示,它提供了证据,证明这些链将成为液滴的主要调节剂。未来的研究将涉及使他们的规则适应模拟 PQC 的体外系统,以在活细胞中证明和测试他们的理论。
Castañeda 说:“这项工作提供了一个原理,可用于理解生物分子凝聚物的一般控制方式,并且对于任何研究他们最喜欢的生物分子凝聚物的调节的人都将产生重大影响。”
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
2025年6月20日,——在世界文化遗产地河南洛阳的光影流转之间,2025年新浪微博旅游之夜盛大举行。作为国内首个...浏览全文>>
-
2025年6月20日,——在世界文化遗产地河南洛阳的光影流转之间,2025年新浪微博旅游之夜盛大举行。作为国内首个...浏览全文>>
-
QQ多米试驾线下预约活动为了让更多用户感受QQ多米的独特魅力,我们特别推出了线下试驾预约活动。这不仅是一次...浏览全文>>
-
阜阳长安启源A07以其卓越的性能和豪华配置吸引了众多消费者的目光。作为一款定位高端市场的新能源车型,长安启...浏览全文>>
-
【安徽淮南大众CC新车报价2025款大公开】大众CC作为一款兼具运动感与豪华质感的轿跑车型,一直深受消费者喜爱...浏览全文>>
-
2025款长安猎手K50在安徽淮南地区的最新价格已新鲜出炉,为准备购车的朋友带来全面解析。这款车型以其高性价比...浏览全文>>
-
在安徽滁州购买长安猎手K50时,了解其落地价和省钱技巧至关重要。长安猎手K50是一款实用性强的皮卡车型,适合...浏览全文>>
-
途锐新能源是大众旗下的一款高端插电混动SUV,目前在安徽阜阳地区有售。其官方指导价约为58万元起,但实际成交...浏览全文>>
-
2025款大众CC作为一款兼具运动与豪华的中型轿车,备受关注。目前市场指导价大约在25万至35万元之间,具体价格...浏览全文>>
-
2024款探岳X作为一款备受关注的中型SUV,在市场上以其时尚的设计和出色的性能吸引了众多消费者。根据最新市场...浏览全文>>
- QQ多米试驾线下预约
- 安徽滁州长安猎手K50落地价,买车省钱秘籍
- 淮南大众CC新款价格2025款多少钱?买车攻略一网打尽
- 瑞虎8 PRO试驾,畅享豪华驾乘,体验卓越性能
- 安徽阜阳长安启源A05多少钱 2025款落地价,换代前的购车良机,不容错过
- 保时捷Macan试驾的流程是什么
- 安徽淮南大众ID.3多少钱?购车攻略在此
- 阜阳揽巡落地价,豪华配置超值价来袭
- 安徽池州威然 2024新款价格与配置的完美平衡
- 奇瑞瑞虎9试驾,新手必知的详细步骤
- QQ多米价格,换代前的购车良机,不容错过
- 池州迈腾GTE新款价格2022款多少钱?选车秘籍与优惠全公开
- 岚图追光多少钱 2024款落地价走势,近一个月最低售价25.28万起,性价比凸显
- 天津滨海威然 2024新款价格,最低售价28.98万起,入手正当时
- 蚌埠途昂新款价格2025款多少钱?购车必看
- 坦克400预约试驾全攻略
- 天津滨海ID.7 VIZZION价格,各配置车型售价全揭晓,性价比之王
- 安庆帕萨特最新价格2025款,最低售价12.35万起,入手正当时
- 亳州宝来新款价格2025款多少钱?选车指南与落地价全解析
- 生活家PHEV 2025新款价格,最低售价63.98万起现在该入手吗?
