阿尔茨海默氏症药物试验显示持续改善的证据
大约四十年前,阿伯丁大学心理健康(临床)主席 Claude Wischik 教授取得了突破,发现与阿尔茨海默病相关的神经原纤维“缠结”是由 tau 蛋白构成的。
从那以后,他一直致力于开发针对和“解决”这些缠结的治疗方法,他认为这是减缓甚至停止影响全球数百万人生活的阿尔茨海默氏症衰弱症状的关键。
这项最初的研究始于 Wischik 教授在剑桥时开始,1997 年他搬到阿伯丁大学时继续进行,五年后,一家名为 TauRx Therapeutics 的公司从大学中剥离出来,将有前途的研究转化为临床。
该公司在 Wischik 教授的领导下,继续专注于阿尔茨海默病中基于 tau 的研究,这与该疾病的许多其他研究方法形成鲜明对比,这些研究方法专注于淀粉样斑块——在阿尔茨海默病患者大脑中发现的第二种病变。它继续与阿伯丁大学合作,主要研究设施和运营位于阿伯丁,公司总部位于新加坡。
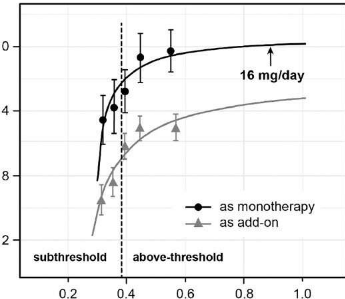
10 月 6 日,TauRx 宣布了一项名为 LUCIDITY 的 3 期临床试验的结果。
该试验比较了使用该公司口服药物甲磺酸氢甲基硫氨酸 (HMTM)(一种有效的 Tau 聚集病理学抑制剂)与给予比较器 (MTC) 的患者的结果,以及与历史对照和其他可用药物的比较。基准数据。
TauRx 报告说:
对于患有早期阿尔茨海默病 (MCI) 的人,HMTM 治疗导致认知能力比治疗前基线持续改善,并且脑萎缩正常化到与健康个体相似的速度
对于轻度至中度阿尔茨海默病患者,与历史匹配的 AD 患者相比,HMTM 稳定了认知和功能并降低了脑萎缩率
TauRx 断言:
LUCIDITY 试验的数据首次提供了 AD 早期临床可检测阶段持续改善和更严重阶段疾病进展稳定的证据。
数据表明,Tau 是一种可行的一线治疗目标,这与 Tau 病理学在临床症状出现前至少 20 年开始的证据一致。
对于患者来说,这意味着在认知和功能下降导致丧失独立性之前,早期干预的可能性。
关于当前数据分析的结果,Wischik 教授解释说:“这是第一次有证据表明,在阿尔茨海默病 (AD) 的早期临床可检测阶段,任何治疗都比个人自己的治疗前基线持续 18 个月持续改善。 ,以及在更严重的阶段稳定疾病进展。
“AD 中的结果证实了两个早期 HMTM 第 3 期试验的已发表结果。可获得的口服治疗不需要对常规临床护理进行昂贵的监测,这为在导致认知和功能衰退开始之前进行干预提供了机会。失去独立性。
“这种疾病的 Tau 病理学现在被认为是治疗的重要目标,令人鼓舞的是,在这种疾病的早期阶段,使用靶向 Tau 的药物就可以看到认知改善。该领域主要关注淀粉样蛋白作为治疗的靶点。 “早期干预。我们的数据与证据一致,即 Tau 病理学在临床症状出现前至少 20 年开始,并且是可行的一线治疗目标。”
该试验未报告与治疗相关的严重不良事件或淀粉样蛋白相关影像学异常(ARIA)的证据。
TauRx 现在将使用来自试验的数据来支持监管提交。为了协助下一阶段,它已在英国、和加拿大任命了战略监管顾问。TauRx 计划于 2023 年在英国、和加拿大提交 HMTM 以供监管机构批准,其他地区也将紧随其后。
该研究结果还将在 2022 年 11 月 30 日星期三在旧金山举行的阿尔茨海默病临床试验 (CTAD) 会议上公布。
第三阶段试验的更多细节
Hydromethylthionine mesylate (HMTM) 是口服的 Tau 聚集病理学的有效抑制剂。3 期 LUCIDITY 研究比较了 HMTM 16 毫克/天与甲基硫鎓氯化物 (MTC) 的剂量,剂量为 4 毫克,每周两次,这是防止潜在尿液变色引起的偏差所需的最低限度。该研究在 598 名 AD 严重程度从轻度认知障碍 (MCI) 到疾病中度阶段的患者中进行。
TauRx 已经完成了第一个为期 12 个月的双盲阶段试验。第二个 12 个月的开放标签期正在进行中,在此期间所有参与者每天接受 HMTM 16 毫克。所有参与者都必须进行阳性淀粉样蛋白-PET 扫描,并且不接受标准的 AD 对症治疗。
在每周两次接受 MTC 4 mg 的患者中,大多数人出乎意料地发现活性药物的血液水平高于产生临床效果所需的阈值。在没有真正的安慰剂的情况下,设计的试验无法确定与预先指定的治疗无效安慰剂相关的主要临床终点的结果。鉴于目前可获得的证据,TauRx 不认为具有临床终点的 HMTM 的有效盲法安慰剂对照试验在技术上是可行的。因此,TauRx 分析了药物血液浓度与治疗效果之间的关系、治疗前基线的变化以及与来自阿尔茨海默病神经影像学倡议 (ADNI) 的密切匹配数据的历史对照的比较数据。
从 MCI 到中度疾病的研究人群的总体基线 MMSE 评分为 21。在最初的 12 个月中,接受 16 毫克/天剂量的参与者在共同主要认知和功能终点(1.3 ADAS-cog11 单位和 -1.0 ADCS-ADL23 单位)方面的下降幅度很小。未经治疗的人群在 12 个月内的预期下降在两个量表上约为 5 个单位。
在接受 16 mg/天剂量的 105 名 MCI(基线 MMSE 评分 23)参与者中,在 6 个月(p=0.0002)、12 个月(p=0.0391 ) 和 18 个月 (p=0.0473) 在 ADAS-cog13 量表上。在 6、12 和 18 个月时,ADCS-ADL 日常生活子量表工具活动的平均变化也保持在治疗前基线之上。
在接受 16 毫克/天的 147 名轻度至中度 AD(基线 MMSE 20)参与者中,前 9 个月认知能力下降 2.5 个单位,在接下来的 9 个月内没有进一步下降。ADCS-ADL 量表的功能下降在 12 个月时为 -2 个单位,在 18 个月时为 -3 个单位,相对于已发表的对来自历史试验的轻度安慰剂下降数据的公开可用安慰剂下降数据的已发表荟萃分析,下降幅度减少了约 75%中度 AD。
通过将接受 16 mg/天剂量的参与者与最接近研究人群的 ADNI 受试者进行比较,证实了通过认知功能变化 (p=0.0008) 和脑萎缩 (p<0.0001) 测量的疾病进展的统计学显着减少年龄和临床严重程度。在 MCI 和 AD 亚组中,差异仍然具有统计学意义。正如预期的那样,与 ADNI 健康老龄化受试者相比,患有 MCI 的 LUCIDITY 试验参与者进入研究的脑萎缩更多,并且与 ADNI MCI 受试者一致。接受 HMTM 16 毫克/天治疗的患者脑萎缩进展率明显低于 ADNI MCI 受试者 (p<0.0001),并且与 ADNI 健康老龄化受试者的脑萎缩进展率相当。
相关研究也发表在《预防阿尔茨海默病杂志》上。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
