发现通过新机制剪接的人类短内含子子集
在人类中,前体 mRNA 的长度差异很大(根据最近的研究,从 30 到 1,160,411 个核苷酸)。剪接的基本机制已经用包括 158-和 231-nt 内含子的模型前 mRNA 进行了研究,例如,它们在体外和体内都非常有效地剪接。这样的理想的前体mRNA含有良好的剪接信号序列,即U1 snRNP识别的5'剪接位点、分支位点(BS)序列和聚嘧啶束(PPT),其后是3'剪接位点,分别为 U2 snRNP 和 U2AF2–U2AF1。梅达教授说:“鉴于人类内含子的长度不同,很可能存在不止一种机制。这是我们开始针对人类短内含子进行剪接研究的动机。”
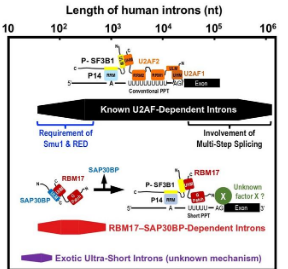
Fukumura博士解释说:“我们之前对短内含子剪接过程的研究表明,真正的剪接因子U2AF2无法与截短的PPT结合,然后用U2AF取代RBM17以促进剪接。你知道,这是合理的,因为短内含子对于 PPT 的足够长度来说通常太紧。我们在2021年发表了这一发现。然而,RBM17在体外无法与截短的PPT结合,因此我们不知道RRM17如何识别截短的PPT和随后的3'剪接位点。因此,我们假设另一种蛋白质因子参与了 RBM17 依赖性剪接。” Mayeda 小组最终确定了 RBM17 依赖性剪接背后的蛋白质辅助因子,即 SAP30BP。他们的研究发表在 2023 年 12 月 7 日的《Cell Reports》杂志第 42 卷第 12 期上。
福村博士表示: “调查以前的参考文献至关重要。从三篇论文中,我确信 SAP30BP 是 RBM17 辅因子的最强候选者。”他们表明,人类早期剪接复合体中存在SAP30BP,果蝇SAP30BP和RBM17在果蝇短内含子上形成的剪接体中检测到,并且通过酵母双杂交分析确实检测到了SAP30BP和RBM17之间的结合。“如今,siRNA 介导的人细胞系中 SAPBP 的消耗是检查 RBM17 依赖性剪接抑制的简单直接方法。这是宾果游戏!”福村博士说。
通过下一代测序仪(RNA-Seq 分析)对 SAP30BP 耗尽的人类细胞中的转录本进行了分析,发现了许多 RBM17 和 SAP30BP 依赖性内含子。这些内含子分布在较短的范围内,截短的 PPT 确实是 RBM17/SAP30BP 依赖性的关键决定因素。因此,RBM17和SAP30BP是通用的剪接因子。
Mayeda 教授表示:“结构分析专家 Michael Sattler 教授对我们的研究非常感兴趣,这是一个幸运的巧合,我们可以开始富有成效的合作。”通过 UHM(U2AF-同源基序)-ULM(UHM-配体基序)结合的蛋白质-蛋白质相互作用在一般剪接反应中发挥着重要作用。 Sattler 实验室在 SAP30BP 中发现了隐藏的 ULM 序列,并通过 NMR(核磁共振)和 ITC(等温滴定量热法)分析证明这对于与 RBM17 中的 UHM 相互作用至关重要。
然而,RBM17-SAP30BP 相互作用的作用仍然是个谜。由于 RBM17 只有一个 UHM,因此 RBM17-SAP30BP 结合必须在 RBM17 与 SF3B1(U2 snRNP 的组成部分之一)相互作用之前释放,SF3B1 对于促进剪接至关重要。那么,RBM17-SAP30BP 相互作用的作用是什么? Mayeda 教授说:“Fukumura 使用抗磷酸 SF3B1 抗体设计了一种智能结合测定法来解决这个奇怪的问题,我们可以提供一个优雅的工作模型(参见图片)。”我们提出中间 RBM17-SAP30BP 复合物可防止非功能性 RBM17 与游离的未磷酸化 SF3B 结合,从而促进功能性 RBM17 与前 mRNA 上的活性磷酸化 SF3B1 结合。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
